Suite à l’excellent article de Raoul Girodet sur les bactéries-miroir ,je m’étais engagé auprès de Christine Tasin à approfondir une des notions évoquées.
Voici comme promis ma contribution sur les isomères et les molécules de le vie.
J’ai essayé de faire le moins rébarbatif possible sur un si vaste sujet.
Vous souhaitant bonne lecture, je suis à l’écoute des critiques.
HAGDIK
LES ISOMERES, MOLECULES DE LA VIE
L’objectif de cette communication est d’expliquer le plus simplement possible :
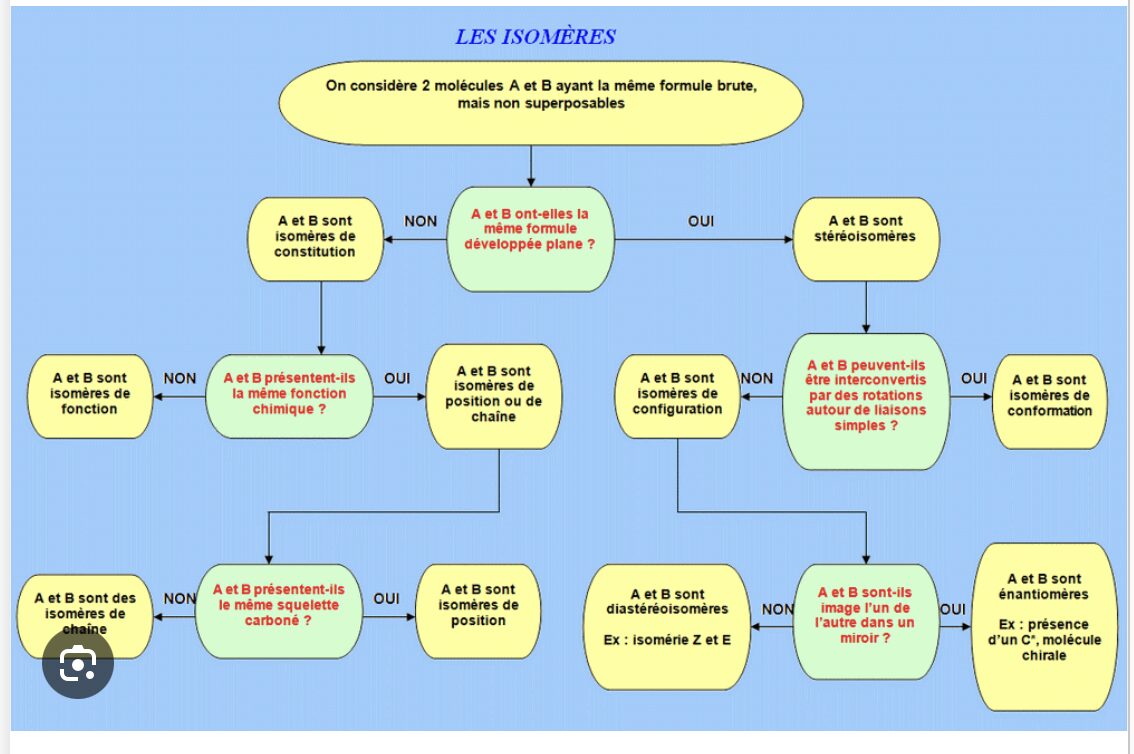
- Ce que sont les isomères chimiques.
- Pourquoi L et D ?
- Cis et Trans.
Je propose un exemple simple avec des cubes.
Découvrir la lumière polarisée.
Aborder succinctement l’importance des isomères au sein des nombreuses molécules indispensables à la vie.
Les isomères concernent la disposition spatiale des atomes dans une molécule. Cela peut sembler un peu compliqué, mais qui peut s’aborder simplement et concrètement.
- Isomères L et D (on les nomme énantiomères ou stéréoisomères).
Les isomères L et D sont des versions miroir l’une de l’autre, comme des mains gauche et droite. Regardez vos 2 mains la paume vers vous. Elles sont pareilles mais pas superposables. Leur symétrie est une symétrie en miroir.
En chimie, des arrangements d’atome formant une molécule peuvent présenter les même caractéristiques que nos mains et faire qu’il existe 2 formes symétriques.
J’ai fabriqué un casse-tête en bois avec de petits cubes qui permet de visualiser ceci.
1e exemple, un arrangement de 3 atomes identiques en ligne. Visiblement il ne peut pas y avoir d’isomère.
2e exemple, un arrangement de 5 atomes identiques en ligne. Là non plus, pas d’isomère.
3e exemple, deux arrangements de 5 atomes identiques avec une architecture spatiale. Les deux “molécules” obtenues sont similaires mais pas identiques et impossible à superposer. Nous avons bien là 2 isomères.
C’est l’analyse par la lumière polarisée qui permet de distinguer ces molécules. Comme la rotation de l’angle de déviation de la lumière polarisée varie entre gauche et droite, les chimistes ont fixé la terminologie en L pour lévogyre donc orienté à gauche (rien de politique là-dedans !) et D pour dextrogyre donc orienté à droite.
En résumé, souvenez-vous de vos mains. Elles sont identiques vues dans le miroir mais pas exactement superposables. En chimie c’est ça la base des énantiomères.
L (Lévo) : C’est la forme qui est souvent utilisée par les êtres vivants. Par exemple, les acides aminés, les blocs de construction des protéines, sont presque tous sous la forme L.
D (Dextro) : L’isomère D est l’image miroir de la forme L. Si vous prenez une molécule L et que vous la regardez dans un miroir, vous voyez une molécule D. Ce sont des copies, mais elles ne sont pas identiques, elles ne s’ajustent pas de la même manière dans les mécanismes biochimiques.
Pour former une molécules, les atomes (par exemple le carbone) sont liés par des liaisons simple (pivot) ou multiples le plus souvent doubles (verrou).Les liaisons multiple fixent la forme des molécules et certaines dispositions d’atomes.
C’est comme un chemin où vous pouvez planter des arbres à droite ou à gauche ou des deux côtés.
Ce sont les isomères Cis ou Trans. Ils concernent la façon dont deux groupes ou atomes sont disposés autour d’une double liaison ou d’un cycle.
Isomère cis : Imaginez deux atomes de carbone reliés par une double liaison. Si les groupes (par exemple, des atomes d’hydrogène ou autres) qui sont attachés à ces atomes de carbone sont du même côté de la double liaison, on parle de cis.
(Les arbres sont plantés du même côté du chemin)
Isomère trans : Si les groupes sont de part et d’autre de la double liaison, on parle d’isomère trans.
(Les arbres sont plantés des deux côtés du chemin).
Les propriétés physiques et chimiques des isomères cis et trans sont différentes, car leur forme spatiale affecte leur réactivité et leur interaction avec d’autres molécules.
EN RESUME :
L (lévogyre)-D (dextrogyre) : ce sont des versions miroir l’une de l’autre (comme la main gauche et droite), souvent utilisées pour décrire des molécules comme des acides aminés ou des sucres.
Cis-trans : ça parle de la disposition des groupes autour d’une double liaison (les groupes sont soit du même côté cis, soit de part et d’autre trans).
C’est cette organisation spatiale qui fait que certaines molécules sont actives dans le corps et d’autres non, car leurs formes influencent leurs possibilités d’interaction avec les autres molécules.
Petit aparté sur la lumière polarisée.
Pour comprendre, partons de la lumière “normale”. La lumière “classique” du soleil par exemple, vibre dans toutes les directions à la fois autour de sa trajectoire. C’est désordonné.
La lumière polarisée, c’est tout simplement de la lumière dont les vibrations ont été “rangées” dans une seule direction. La lumière est mise en ordre.
Comment la lumière devient-elle polarisée ?
Le plus courant dans la nature, par réflexion. Quand la lumière rebondit sur une surface (eau, neige, route mouillée, vitrage), elle peut naturellement devenir partiellement polarisée.
L’autre moyen, technique, par un filtre polarisant.
Si vous avez porté des lunettes de soleil polarisantes, vous pouvez voir disparaitre certains reflets, voir apparaître les nuages dans le ciel. Si vous êtes amateur de photo, le filtre polarisant améliore les densités de couleur de manière spectaculaire. Si vous êtes pêcheur vos verres polarisants vous permettent de voir dans l’eau de la rivière.
Et en sciences, pour étudier la structure des matériaux en mesurant le pouvoir rotatoire des molécules en solution.
En résumé simplement, la lumière normale c’est comme une foule qui se déplace en désordre en s’agitant sur un chemin. La lumière polarisée c’est plutôt une troupe marchant en ordre en regardant tous du même côté.
Et, pour finir, revenons au molécules de la vie.
L’acide L-ascorbique est la forme active de la vitamine C chez les êtres humains et la plupart des autres animaux, tandis que l’acide D-ascorbique est une forme inactive qui n’a pas les mêmes effets bénéfiques pour la santé. La différence entre les deux formes réside dans la configuration spatiale des atomes de carbone dans la molécule, ce qu’on appelle les stéréoisomères.
Voici une explication plus détaillée :
Structure chimique et stéréochimie
L’acide ascorbique est une molécule avec plusieurs atomes de carbone en configuration asymétrique, ce qui signifie que ses différentes formes peuvent être des énantiomères, des versions miroir l’une de l’autre. Les deux formes (L et D) sont des isomères optiques, mais seule la forme L-ascorbique a une activité biologique efficace chez les humains et les autres primates.
Pourquoi L-ascorbique ?
Dans la nature, l’enzyme responsable de la synthèse de la vitamine C chez les organismes qui peuvent la produire, comme les plantes et certains animaux, fabrique spécifiquement la forme L de l’acide ascorbique. C’est cette forme qui interagit de manière efficace avec les enzymes humaines et les récepteurs de nos cellules pour accomplir les fonctions biologiques essentielles de la vitamine C, telles que la protection contre le stress oxydatif et la synthèse du collagène.
Pourquoi pas D-ascorbique ?
L’acide D-ascorbique n’est pas utilisé par l’organisme humain. Bien que chimiquement très similaire, il ne possède pas les mêmes propriétés bioactives. En fait, l’acide D-ascorbique pourrait être perçu par l’organisme comme une substance étrangère, car nos enzymes et récepteurs sont conçus pour interagir avec la forme L.
Un clin d’œil pour finir avec la vitamine C, croquez-en 500 mg chaque jour pour bien passer l’hiver. La chimie fine la synthétise depuis plus de 60 ans pour produire un “alicament” de haute qualité. Quelle est la différence entre la vitamine C de synthèse et la vitamine C naturelle ou bio ?
Réponse : il n’y en a qu’une … le prix !
Si vous avez eu le courage de me lire jusqu’ici, on va pousser un peu plus loin.
Il existe énormément d’autres exemples de molécules qui, comme l’acide L-ascorbique (vitamine C), se présentent sous différentes formes énantiomériques (énantiomères D et L), mais où seule l’une de ces formes est biologiquement active ou indispensable pour la vie. Cela s’explique généralement par la stéréospécificité des enzymes et des récepteurs dans les organismes vivants.
Il n’est pas question ici d’approfondir un sujet aussi immense mais voici quelques exemples :
Les acides aminés.
Les acides aminés, qui sont les blocs de construction des protéines, présentent souvent une asymétrie stéréochimique. En effet, chaque acide aminé (à l’exception de la glycine) possède un atome de carbone central asymétrique, ce qui permet l’existence de deux formes : D et L. Cependant, seules les formes L des acides aminés sont utilisées pour synthétiser les protéines dans les organismes vivants.
Exemple : Le L-alanine est utilisé pour fabriquer des protéines, tandis que la forme D (D-alanine) n’est généralement pas incorporée dans les protéines, bien qu’elle puisse être trouvée dans certaines structures, comme la paroi cellulaire des bactéries.
Le glucose (et autres sucres).
Le glucose est un sucre qui existe sous différentes configurations spatiales. Le D-glucose est la forme qui est utilisée par les organismes vivants pour produire de l’énergie, notamment dans la respiration cellulaire. La forme L-glucose, bien qu’elle soit chimiquement similaire, ne peut pas être métabolisée de la même manière par le corps humain.
Exemple : Le D-glucose est un sucre central dans le métabolisme énergétique, tandis que L-glucose n’est pas utilisé par les cellules de la même manière et ne peut pas être métabolisé efficacement par les enzymes humaines.
Les nucléotides.
Les nucléotides (qui forment l’ADN et l’ARN) sont également des molécules stéréospécifiques. Par exemple, dans l’ADN, les sucres qui forment l’épine dorsale des brins d’ADN sont des désoxyriboses (une forme de sucre à cinq atomes de carbone), et seule la forme D de la désoxyribose est utilisée dans la construction de l’ADN. De même, l’ARN utilise la ribose D.
Exemple : Les sucres dans les acides nucléiques, comme le D-ribose dans l’ARN et le D-désoxyribose dans l’ADN, sont les seules formes biologiquement actives et nécessaires à la construction de l’ADN/ARN.
Les acides gras essentiels.
Les acides gras sont souvent des composés à chaîne longue avec plusieurs centres asymétriques, et leur forme géométrique (cis ou trans) influence leur rôle biologique. Les acides gras cis sont largement utilisés dans le corps pour la construction des membranes cellulaires et comme sources d’énergie. À l’inverse, les formes trans, comme celles retrouvées dans les graisses trans artificielles, sont souvent associées à des effets néfastes sur la santé.
Exemple : Les acides gras oméga-3, comme l’acide alpha-linolénique (ALA), ont des configurations cis naturelles et sont bénéfiques pour la santé cardiovasculaire, tandis que des formes trans (comme celles des graisses hydrogénées) sont moins bénéfiques et plus risquées pour la santé.
La vitamine A (rétinol).
La vitamine A, qui joue un rôle clé dans la vision et la santé de la peau, existe sous plusieurs formes chimiques, y compris le rétinol, les rétinoïdes et les caroténoïdes. Les molécules de rétinol, qui sont des dérivés de la vitamine A, doivent avoir une configuration stéréochimique spécifique pour être biologiquement actives. La forme trans du rétinol est la plus active, tandis que la forme cis est moins efficace dans le corps, bien qu’elle puisse se convertir en forme trans.
Les flavonoïdes.
Les flavonoïdes sont une classe de composés polyphénoliques présents dans de nombreux fruits, légumes et plantes. Ces molécules ont plusieurs configurations stéréochimiques et peuvent avoir différentes activités biologiques. Certaines configurations peuvent influencer leur biodisponibilité, leur absorption et leur effet antioxydant. Par exemple, les flavonoïdes de type quercétine ont des effets biologiques marqués, tandis que d’autres formes peuvent être moins actives.
L’ATP (adénosine triphosphate).
L’ATP est une molécule essentielle pour le transfert d’énergie dans les cellules. La forme D de l’ATP est la seule forme utilisée par les cellules vivantes, bien que théoriquement d’autres isomères pourraient exister. La forme spécifique est stéréospécifique, car les enzymes qui catalysent les réactions impliquant l’ATP sont conçues pour interagir avec cette forme particulière.
En résumé
De nombreux composés biologiquement actifs possèdent des formes énantiomériques (D et L) ou des configurations géométriques (cis et trans) différentes, mais seules certaines sont biologiquement pertinentes. La spécificité des enzymes et des récepteurs qui reconnaissent ces molécules fait que l’organisme utilise préférentiellement une forme spécifique pour accomplir des fonctions vitales. Cela souligne l’importance de la stéréochimie dans les processus biologiques indispensables à la vie..
958 total views, 307 views today



J’aurais aimé t’avoir comme prof en sciences-ex.
Le Créateur n’est pas gentil d’avoir inventé de telles vacheries. La composition globale peut être la même en nombre d’atomes et radicaux mais des dispositions différentes changent totalement les propriétés biologiques. C’est comme les arbres le long d’une route, lorsqu’ils sont tous d’un même côté, on les évite plus facilement.
Merci d’avoir rendu compréhensible ce sujet ardu.
Merci Armand belle image pour aider les non sciencifiques comme moi à mieux comprendre
Moi j’ai compris en tout cas une chose: Nous, nous sommes la forme L qui interagit de manière efficace et les musulmans, la forme D qui interagit … ☹ !
Bonjour,
Bravo et merci Hagdik pour cet article passionnant !
On pourrait ajouter à ton exposé le drame de la thalidomide, dans les années 50.
Une version de la molécule (un « énantiomère ») était un anti-nauséeux.
L’autre version entrainait de très graves malformations du foetus.
Les deux formes ayant été mal « triées » par le fabricant, des dizaines d’enfants sont nés avec de très graves malformations.
Merci Antiislam pour ce rappel, j’avais oublié…
L’image exemple des cubes a disparu ?
Bonjour,
Oui, j’ai vu, je ne sais pas, c’est dommage : peut-être que Christine n’a pas pu l’éditer.
(Le modérateur).
Je n’ai pas vu d’image dans votre envoi.. est-ce moi qui ai mal vu ? Je vais rechercher
Merci pour cet article. J’ai pas tout compris mais pour la vitamine C c’est important de préciser que la C chimique est aussi bonne que celle considérée comme naturelle. Sauf le prix… Merci Hagdik.
Bonjour Hagdik, et merci! C’est un peu lourd à digérer pour un dimanche matin, mais on se couchera en ayant apris quelque chose. Bonne journée.
Le sujet est si vaste !
Merci.